| 水生所首次揭示蓝细菌中去酰基化酶CddA的结构与功能 |
| 文章来源: | 发布时间:2020-08-04 | 【打印】 【关闭】 | 浏览:次 |
|
蛋白质赖氨酸上的酰基化修饰是一种精细的调节过程,往往由对应的酰基转移酶和去酰基化酶对蛋白质赖氨酸上的一个或多个位点进行酰基化和去酰基化修饰,从而改变蛋白的结构与功能,对细胞内众多代谢相关通路进行精确的调节与控制。然而,蓝细菌中是否存在相应的去酰基化酶,这些酶催化的靶标蛋白又有哪些?以及调控底物蛋白的作用机制是怎样的?目前还知之甚少。由于蛋白质翻译后修饰系统参与了蓝细菌的胁迫响应、能量代谢以及光合作用等一系列的进程,是蓝细菌信号转导网络的重要组成部分,且发挥着关键的调控作用,发现蓝细菌中去酰基化酶并了解其功能,将有助于我们全面理解蓝细菌的光合作用等重要的生物学过程。
中国科学院水生生物研究所赵进东院士和葛峰研究员团队前期在蓝细菌中系统性地鉴定到20多种不同的蛋白质翻译后修饰,揭示了这些可逆的蛋白质翻译后修饰在光合系统以及其他重要的生物学过程中发挥着重要的调控作用(PNAS,2014,111(52):E5633-E5642)。在此基础上,该研究团队通过生物信息学分析发现,在蓝细菌Synechococcus sp. PCC 7002中存在一个可能的去酰基化酶CddA (cyanobacterial deacetylase/ depropionylase),深入的功能实验表明,该酶具有显著的去乙酰化和去丙酰化酶的活性;同时,该基因敲除后导致藻细胞的生长速率显著减慢,并且光合作用过程也受到显著地影响,提示CddA调控的底物蛋白修饰可能参与了蓝细菌中重要的生物学进程。为了进一步揭示蓝细菌中去酰基化酶CddA的功能与作用机制,该研究团队与中山大学刘迎芳教授合作解析了CddA的三维结构。通过结构分析发现,该酶由10个β折叠和12个α螺旋结构组成,并形成一个管状口袋结构,能够与底物蛋白以及锌离子结合进而发挥催化作用;通过点突变实验证实了维持酶活性的关键位点。为了鉴定CddA的作用靶标,该研究团队利用高通量质谱技术系统地鉴定了蓝细菌中的丙酰化和乙酰化修饰蛋白,这些修饰蛋白广泛分布于光合作用过程与其它重要的代谢通路中。进一步功能实验发现,在碳代谢通路中的果糖/景天庚酮糖-二磷酸酶(F/SBPase)是CddA酶的靶标底物之一,CddA通过去除F/SBPase蛋白的乙酰化和丙酰化修饰,进而调控F/SBPase的酶活性。该研究首次发现并揭示了去酰基化酶CddA的三维结构及其在蓝细菌中的功能与作用机制,为进一步研究酰基化修饰在光合生物中的功能提供重要的理论基础与新的研究思路。 该研究成果“Structural and functional insights into a lysine deacylase in the cyanobacterium Synechococcus sp. PCC 7002”在线发表在Plant Physiology杂志,水生所博士生刘欣和高级实验师杨明坤为该论文的并列第一作者,葛峰研究员与赵进东院士为共同通讯作者。该研究得到国家重点研发计划,自然科学基金和中科院关键技术人才项目等资助。 文章链接:http://www.plantphysiol.org/content/early/2020/07/27/pp.20.00583 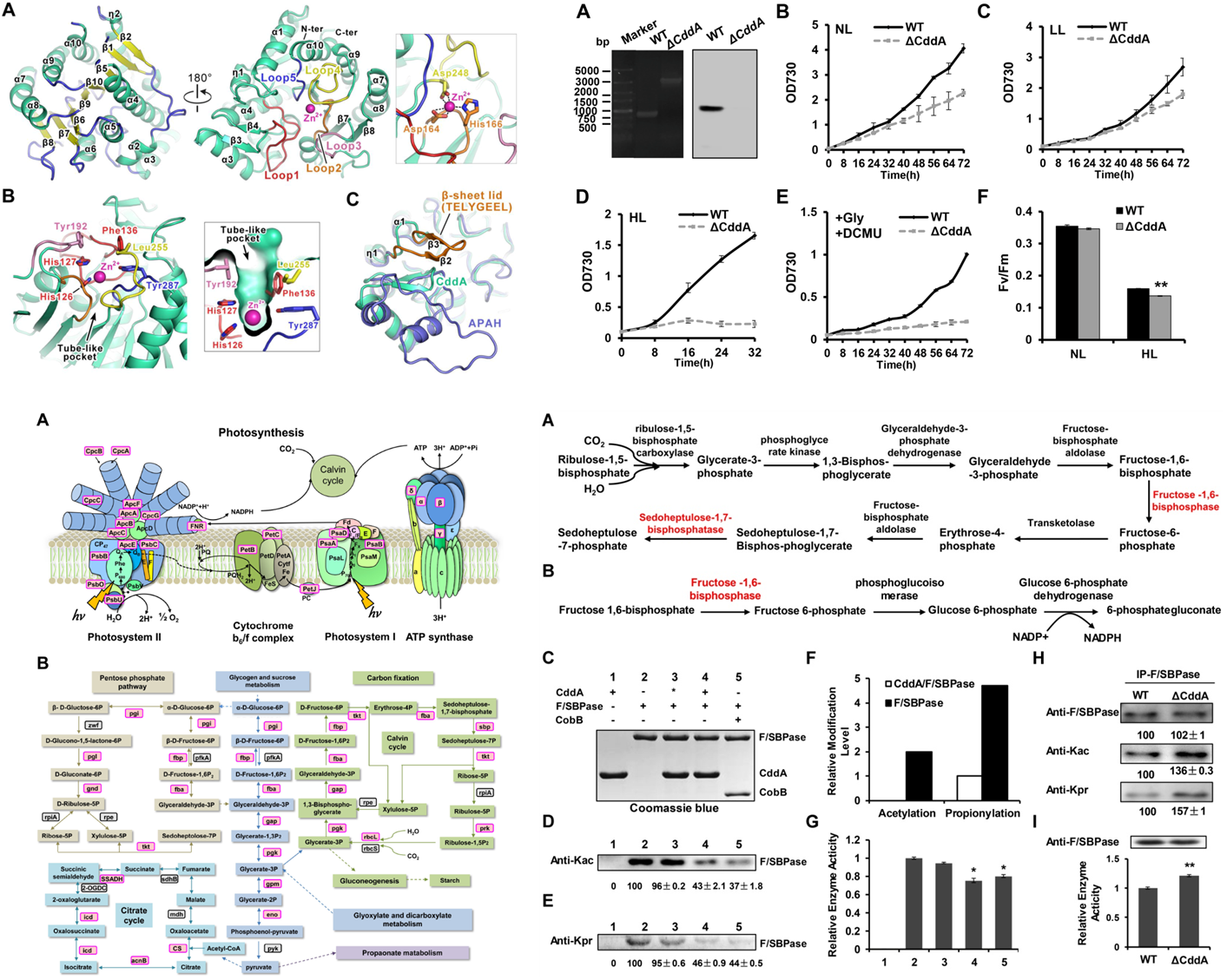 通过综合采用分子生物学,结构生物学和蛋白质组学等多种技术手段揭示了蓝细菌中去酰基化酶CddA的结构与功能 |